פריאימפלנטיטיס – מחלה חדשה נשוא טכנולוגיה חדשה
בכל שנה מתבצעות כמיליון השתלות שיניים ברחבי העולם. ישראל נמנית על אחת המדינות המובילות במספר השתלים המבוצעים בשנה לעומת גודל האוכלוסיה כאן.למרות ששימוש בשתלים מייצג טכנולוגית מתקדמת וחדישה, ולמרות שלטיפול בעזרת שתלים דנטליים יתרונות רבים,אין מדובר בפרוצדורה נטולת סיבוכים; אחד מסיבוכים אלה הוא דלקת סב השתל – פריאימפלנטיטיס. חולי זה נחשב לנפוץ מבין הסיבוכים הקשורים בשתלים דנטליים, והוא גם הסיבה הנפוצה ביותר לאבדן שתלים ונזק לעצם הלסת.
שתלי (יש המאייתים – משתלי) שיניים הם תחליף מלאכותי לשורש השן - חלק השן הנמצא בתוך הלסת, ומעוגן בה. בדרך כלל, השתל עשוי טיטניום וצורתו צורת גליל או בורג. בשיטת ההשתלה הקלאסית, הנפוצה עוד משנות ה - 80 של המאה הקודמת, מחדירים את השתל אל הלסת ומקבעים אותו ברקמה הגרמית. השלב הבא הוא שלב ההמתנה לקליטת השתל בעצם הלסת, תהליך שבמהלכו העצם נצמדת לשתל הטיטניום עד שנוצר ביניהם איחוי; התהליך מכונה אוסאואינטגרציה. בסיום שלב ההמתנה משוקם השתל באמצעות כתר המהווה תחליף אנלוגי לכותרת השן. אורך תפקוד שתל תקין משתנה, והממוצע עומד על כעשר שנים; הישרדות השתל תלויה במספר גורמים ובהם מצב בריאותו של המתרפא, ומצב התחזוקה של השתל (ניקוי נכון וביקורים תקופתיים אצל שיננית), והפעלת כוחות תפקודיים נכונים על הכתר.
(תמונה מס' 1 – איור המשווה שן טבעית לשתל מלאכותי).
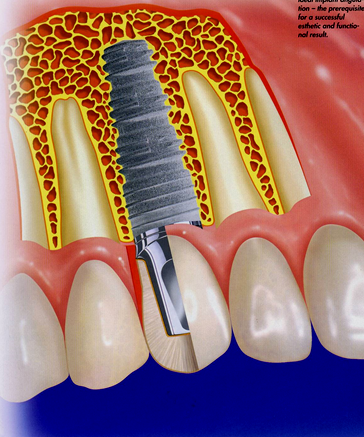
להשתלת שיניים נזקקים בדרך כלל אנשים שבפיהם חסרות שיניים. חסר שיניים נגרם בעיקר ע"י מחלות חניכיים מתקדמות, טיפולי שורש כושלים, עששת נרחבת, חבלות וגורמים גנטיים. תנאים מוקדמים לקליטה מוצלחת של שתלים הם הגיינה טובה של המשנן השאריתי, העדר מחלות חניכיים וסביבת פה בריאה. לעומת זאת ידוע שעישון, בעיקר עישון 'כבד',מחלות סיסתמיות כמו סוכרת, אי תפקוד של בלוטת התריס ואוסטיאופורוזיס מקטינים את שיעורי ההצלחה באופן ניכר. במתרפאים הסובלים מסוכרת לא מאוזנת, חולים הנוטלים סטרואידים או מטופלים בהקרנות, יש הממליצים להימנע כליל מהשתלת שיניים.
למרות שטפול בעזרת שתלים דנטליים מאופיין בשיעורי הצלחה גבוהים, שיעור ניכר מהמטופלים ( כ 10%) לוקים במהלך השנים בדלקת כרונית האופיינית לרקמות הסובבות את השתל. המחלה מתבטאת תחילה [DA1] בנפיחות [DA2] , דימום, והפרשה דלקתית. [DA3] בשלב זה המחלה נקראת מוקוזיטיס - שלב הפיך של המחלה שבו סילוק רובד החיידקים והמשקעים המסוידים בסביבת השתל בשילוב עם שיפור בהיגינה אורלית מחזירים את הרקמות הסובבות את השתל למצב של בריאות ויציבות. ללא טיפול המוקוזיטיס להתפתח [DA4] גם לאבדן עצם סביב השתל.בשלב זה המחלה [DA5] עוברת לפזה בלתי הפיכה הנקראת פריאימפלנטיטיס. ע"פ מחקרים מסויימים פריאימפלנטיטיס מופיעה ב 28-56% של מטופלים או ב 12-43% מהשתלים (Zitzmann & Berglundh JCP 2008),
שמה של המחלה נגזר ממחלה דומה – פריודונטיטיס, המאופיינת ע"י דלקת כרונית סביב שרשי שיניים טבעיות, ומערבת את רקמות התמיכה סביבן. בעוד פריודונטיס היא מחלה עתיקת יומין, וימיה כנראה כימי המשנן האנושי ,פריאימפלנטיטס היא מחלה חדשה, וקיומה עשרות שנים בלבד, וזאת כמשך הזמן בו מבוצעים שתלים בפינו. למרות האנלוגיה הקיימת בין שתי המחלות, מדובר במחלות בעלות אתיולוגיה זהה אך שונות בהתקדמותן ובהשפעתן על הרקמות.בפריאימפלנטיטיס מתרחש ברוב המקרים הרס נרחב של הרקמה הרכה הסובבת את השתל והחוצצת בין חלל הפה לבין העצם התומכת בשתל .הרס זה מלווה בחדירה של התסנין הדלקתי בסמיכות ולתוך מיח העצם. כתוצאה מכך מתרחש הרס ניכר ומהיר של העצם התומכת בשתל. פריודונטיטיס במשנן הטבעי מתקדמת בד"כ לאט ורק במקרים מסוימים של מחלה פריודונטלית אגרסיבית ( עד כ3% מהאוכלוסיה) הופכת התקדמותה למהירה. . מכאן מובנת החשיבות הגדולה לאבחנה מוקדמת של פריאימפלנטיטיס, והטיפול המהיר בה. הטיפול במחלות שונה: ובעוד הטיפול בפריודונטיטיס נחשב טיפול המאט את הרס מנגנון התמיכה של השן באופן משמעותי,ובמקרים רבים אפילו עוצר אותו לחלוטין, הטיפול בפריאימפלנטיטיס מניב תוצאות חלקיות הן מבחינת שיקום הרקמות הפגומות והן מבחינת יציבות התוצאות לאורך זמן. הטיפול בפריאימפלנטיטיס נמצא עדיין בראשיתו וטרם נמצאה דרך בדוקה למגר את המחלה. [DA6]
השוני בפתוגנזיס של שתי המחלות מקורו כנראה בשוני במפגש שבין הרקמות הרכות והקשות לבין השן הטבעית לעומת המפגש של אלה עם פני שטח השתל. הרקמה הרכה סביב השן קשורה לשן באמצאות סיבי קולגן אשר עוברים ממלט השן לעצם ומתפרסים גם לתוך נרקמה הרקמת החיבור ומהווים את מנגנון התאחיזה של השן. לעומת זאת סיבי הקולגן שברקמה הרכה שסביב השתל אינם מחוברים אליו אלא מפוזרים במקביל וצמודים אל פני שטח פניו (אדהזיה). כמו כן, אספקת הדם לרקמות הרכות סביב השתל הינה מכלי דם שמקורם מעצם בלבד לעומת הליגמנט הפריודונטי הממוקם בין העצם המכתשית לבין פני שטח שורש השן. שוני זה באספקת הדם גם הוא ,קרוב לוודאי, בעל השפעה שלילית על בלימת התהליך הדלקתי סביב השתל.
כדי להמנע מפריאימפלנטיטיס יש לנקוט מספר פעולות מנע שתחילתן עוד בטרם בוצעה ההשתלה. היות שפריאימפלנטיטיס היא מחלה דלקתית, זיהומית, נוכחות אוכלוסיית חיידקים פתוגניים בפה יכולה לעודד את התפתחות המחלה. לפיכך, יש לוודא שסביבת הטפול בשתלים בריאה, דהיינו – השיניים שנותרו בפה, והחניכיים סביבן בריאות או מטופלות ומתוחזקות כראוי.
תנאי נוסף להצלחת ההשתלה הוא מיקום נכון של השתלים. השתלים צריכים להיות מוקפים בעצם בעלת נפח מתאים, להימצא במרחק תקין זה מזה, לאפשר גישה נוחה לניקוי לאחר ההשתלה והשיקום, ולהיות ממוקמים כשציר האורך שלהם נמצא ככל שניתן בכיוון הכוחות המופעלים עליהם. סטיות מכללים אלה עלולות ללהקטין את חיפוי הרקמה הגרמית, בעיקר באספקט הבוקלי של השתל; במקרים אלה ספיגת עצם איטית אך מתמשכת נצפתה במקרים רבים, ספיגה שאיננה ניתנת לעצירה גם ע"י שמירת הדיינה טובה. ( תמונה מס' 2 – יואלה הר שפי).
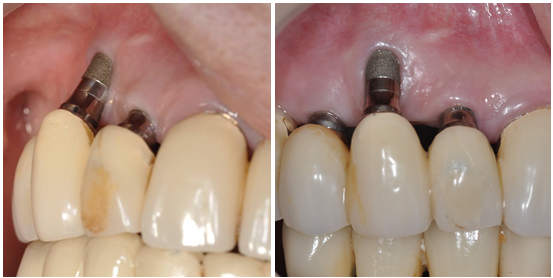
היות שמדובר בתנאים שרובם מוכתבים ע"י המבנה האנטומי של הלסתות וע"י שינויים פתולוגיים שחלקם התרחשו בלסת עוד בטרם אבדו השיניים , וחלקם לאחר עקירתן, יש לבדוק את הנתונים כולם מראש, ולתכנן את ההשתלה בקפידה. העזרים המקובלים ביותר לשם כך הם מדידות הלסת, תצלומי רנטגן של הלסתות, וסריקות טומוגרפיה ממוחשבת ( CT ) של אזור ההשתלה. באמצעות עזרים אלה ניתן גם לאתר מבנים אנטומיים חשובים הנמצאים באזור ההשתלה ( כלי דם, עצבים, חללי סינוס), ולהמנע מפגיעה בהם. כיום יש גם תוכנות מחשב המסייעות לתכנן את הניתוח ולכוון את מיקום השתל ומימדיו.
כמו בדלקת חניכיים ובפריודונטיטיס מרבית מקרי פריאימלנטיטיס נגרמים ע"י זיהום חיידקי המתאפיין בנוכחות חיידקים גרם-שליליים אנאארוביים, חיידקים מוטיליים וספירוכטות . חיידקים אלה, ובעיקר רעלנים המשתחררים מהם גורמים לתגובות אימונולוגיות ברקמות שסביב השתל. בין השאר מתחולל שיפעול של ציטוקינים פרו-דלקתיים, ותאים הנמצאים ברירית הפה מפרישים חומרים המאופיינים בפעילות הרסנית ( קטאבולית) המקדמת את הרס הרקמות התומכות בשתל, הן רקמת החיבור הרכה, והן העצם. מעקב קליני מראה שבהתחלה הרירית המקיפה את השתל הופכת בצקתית , תופחת , מאדימה ונוטה לדמם במגע; בהמשך נוצר נתק בינה לבין השתל, נתק המאפשר אכלוס ע"י חיידקים נוספים. בהמשך מופיע תפליט דלקתי, ואח"כ גם תפליט מוגלתי. במקביל מתחילה ספיגה של הרקמה הגרמית התומכת בשתל; ספיגת העצם ניתנת למדידה באמצעות תצלומי רנטגן ובדיקות קליניות. תהליך ספיגת העצם איטי בד"כ, ומתחיל ברכס הגרמי. בהמשך הוא מתקדם לאורך השתל, ולבסוף, ללא טיפול ראוי, עלול התהליך לגרום לאובדן השתל. התקדמות המחלה איננה גורמת בד"כ לכאבים, ומרבית המתרפאים אינם מודעים להתרחשותה.
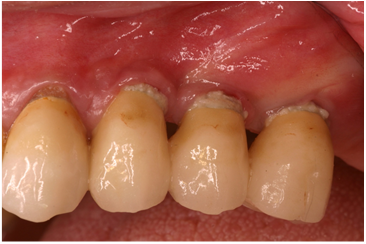
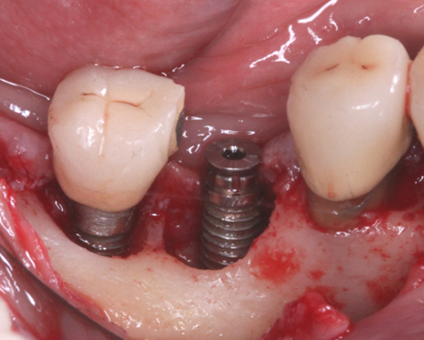
למחלת הפריאימפלנטיטיס השלכות אפשריות גם מעבר לפגיעה הישירה במשנן המשוקם על גבי השתלים, ולפגיעה המקומית ברקמות הלסת. מזה שנים רבות נחשדו מוקדי דלקת כרונית בגוף בכלל, וזיהומים כרוניים בפה ובחניכיים בפרט, כמקור לזיהומים ותהליכים פתולוגיים באזורים המרוחקים מהפה. אף שהרעיון עלה וירד מסדר היום הרפואי משך עשרות בשנים , לאחרונה הוא זכה לתשומת לב מחודשת. מחקרים רבים מצביעים על האפשרות של קיום קשר סיבתי בין מחלות פריודונטליות כרוניות לבין מחלות אחרות בגוף. בין השאר נמצא מתאם בין תחלואה פריודונטלית לבין תחלואה במחלת לב קורונרית וטרשת עורקים סוב-קלינית, אירועי אוטם שריר הלב, שבץ מוחי, לידת פגים בטרם עת, והחמרת סוכרת ומחלות דרכי הנשימה. למרות ריבוי המחקרים האפידמיולוגיים התומכים בממצאים אלה קיימים גם מחקרים שהצביעו על חוסר קשר מובהק בין המחלות ולפיכך יש להתייחס למחקרים אלה בזהירות . מחקרים שבדקו את השפעת הטפול במחלות פריודונטליות על סימני מחלות כלי הדם והלב דווחו על שיפור במדדים הקשורים למחלות כלי דם – לב , אבל מדובר בממצאים ראשוניים ובמסקנות שיש לבחון אותן על פני זמן רב.
בשל הדמיון הרב בין סימני המחלה הפריודונטלי לבין סימני הפריאימפלנטיטיס, יש בסיס מוצק לחשש שהפריאימפלנטיטיס כמו הפריודונטיטיס מהווה אף היא מוקד של זיהום כרוני שעשויה להיות לו השפעה על מחלות סיסתמיות של כלי הדם והלב. בדומה לכיס הפריודונטי והרקמות סביבו, גם הרקמות הסובבות את השתל יכולות לשמש מאגר לתוצרים בקטריאליים וחומרים משרי דלקת המתפזרים לדם ופועלים על תאים ורקמות מרוחקים ממקום המחלה המקורית. בדיקות הרקמות סביב שתלים הלוקים בפריאימפלנטיטיס מצביעות על כך שבמחלה זאת התוקפת את הרקמות סביב השתל כמות הרקמה הניזוקה והחמרים הפתולוגיים שהיא מכילה עולים כמה מונים על אותם מדדים בהשוואה לפריודונטיטיס.
בהיות פריאימפלנטיטיס מחלה "חדשה" יחסית, השיטות לטיפול במחלה זאת טרם נחקרו דיין, ולא עמדו במבחן הזמן. הואיל ומדובר במחלה זיהומית, טיפול אנטי בקטריאלי הנו ללא ספק אחד מהאמצעים העומדים לרשותנו. כמו בפריודונטיטיס גם כאן השימוש באנטיביוטיקה מתאים לטיפול קצר טווח היות ששימוש באנטיביוטיקה גורם להופעתם של זני חיידקים עמידים, ומאבד מיעילותו במהירות. שימוש בחמרים אנטיספטיים מקומיים, וטיפולים המתמקדים בשיפור ההגיינה סביב השתלים הן ע"י המתרפא, והן ע"י הצוות הרפואי הם התשובה ההולמת בשלבי המחלה המוקדמים, זאת כל זמן שניתן להביא לסילוק הדלקת, וכל זמן שלא נוצרו כיסים גרמיים המונעים גישה למצבורי החיידקים המתמקמים בהם. בשלבים מתקדמים יותר, כאשר קיים נזק ניכר לעצם הלסת, ניתן לבצע פעולות ניתוחיות בדומה לניתוחים פריודונטליים ("ניתוחי חניכיים"). במהלך טיפול זה מופרדת רקמת החניכיים מהשתל הנגוע, השתל והעצם נחשפים, הרקמה הנגועה מסולקת, פני השתל עוברים ניקוי וחיטוי יסודיים, ורקמת החניכיים מוצמדת ומיוצבת בסמוך לפני העצם, זאת על מנת ליצור ריפוי המונע התארגנות מחודשת של הרובד החיידקי האחראי להתפתחות המחלה. יש המצדדים גם בביצוע השתלת רקמה גרמית סביב השתל, זאת בניסיון לשחזר חלק ממערכת התמיכה שאבדה. שיעורי ההצלחה של הטפולים במחלת הפריאימפלנטיטיס נמוכים משיעורי ההצלחה בטיפול בפריודונטיטיס, בין השאר משום שפני שטח השתל הדנטלי מחוספסים וקשה מאד להחליקם. חיספוס זה מהווה יתרון בחיבור השתל לעצם, הינו בחזקת אליה וקוץ בה: ככל שפני השתל מחוספסים יותר האפשרות לנקותם ניקוי מושלם נמוכה יותר, ומשנחשפו לסביבת הפה, שמירתם נקיים קשה יותר.לפיכך יש הממליצים על שיוף והחלקת פני השתל באמצעיםפ מכניים, יהלום ואבני ליטוש, זאת בהנחה שפני השתל חלקים ונקיים יעודדו הצמדות מחדש של רקמת החיבוא הגינגיבלית והאפיתל, לשתל, ויאפשרו שמירת הגיינה טובה. אין ספק שהאתגר העיקרי העומד כיום בפני קהילת החוקרים העוסקים בשיפור ופיתוח השתלים הדנטליים הוא מתן מענה הולם למחלה החדשה, שהיא פרי הקדמה הרפואית.
רשימת קריאה מומלצת
Abrahamsson, I., Berglundh, T. & Lindhe, J. (1998). Soft tissue
response to plaque-formation at different implant systems.
A comparative study in the dog. Clinical Oral Implants
Research 9, 73–79.
Albrektsson, T. & Isidor, F. (1994). Consensus report: Implant
therapy. In: Lang, N.P. & Karring, T., eds. Proceedings of the
1st European Workshop on Periodontology. Berlin: Quintessence,
pp. 365–369.
Berglundh, T., Lindhe, J., Ericsson, I, Marinello, C.P., Liljenberg,
B. & Thomsen, P. (1991). The soft tissue barrier at
implants and teeth. Clinical Oral Implants Research 2, 81–90.
Berglundh, T., Lindhe, J., Ericsson, I, Marinello, C.P. & Liljenberg,
B. (1992). Soft tissue reactions to de novo plaque formation
at implants and teeth. An experimental study in the
dog. Clinical Oral Implants Research 3, 1–8.
Berglundh, T., Persson, L. & Klinge, B. (2002). A systematic
review on the incidence of biological and technical complications
in implant dentistry reported in prospective longitudinal
studies of at least 5 years. Proceedings from the 4th
European Workshop on Periodontology. Journal of Clinical Periodontology
29 (Suppl), 197–212.
Berglundh, T., Gislason, Ö., Lekholm, U., Sennerby, L. &
Lindhe, J. (2004). Histopathological observations on human
periimplantitis lesions. Journal of Clinical Periodontology 31,
341–347.
Berglundh, T., Gotfredsen, K., Zitzmann, N., Lang, N.P. &
Lindhe, J. (2007). Spontaneous progression of ligature
induced periimplantatitis at implants with different surface
roughness. An experimental study in dogs. Clinical Oral
Implants Research, 18, 655–661.
Brägger, U., Aeschlimann, S., Bürgin, W., Hämmerle, C. &
Lang, N.P. (2001). Biological and technical complications
and failures with fi xed partial dentures (FPD) on implants
and teeth after four to fi ve years of function. Clinical Oral
Implants Research 12, 26–34.
Ericsson, I., Berglundh, T., Marinello, C.P., Liljenberg, B. &
Lindhe, J. (1992). Long-standing plaque and gingivitis at
implants and teeth in the dog. Clinical Oral Implants Research
3, 99–103.
Ericsson, I., Persson, L.G., Berglundh, T., Edlund, T. & Lindhe,
J. (1996). The effect of antimicrobial therapy on peri-implantitis
lesions. An experimental study in the dog. Clinical Oral
Implants Research 7, 320–328.
Esposito, M., Hirsch, J.M., Lekholm, U. & Thomsen, P. (1998).
Biological factors contributing to failures of osseointegrated
oral implants. (I) Success criteria and epidemiology. European
Journal of Oral Sciences 106, 527–551.
Fransson, C., Lekholm, U., Jemt, T. & Berglundh T. (2005).
Prevalence of subjects with progressive loss at implants.
Clinical Oral Implants Research 16, 440–446.
Fransson, C., Wennström, J. & Berglundh T. (2007). Clinical
characteristics at implants with a history of progressive
bone loss. Clinical Oral Implants Research, in press.
Gotfredsen, K., Berglundh, T. & Lindhe, J. (2002). Bone reactions
at implants subjected to experimental peri-implantitis
and static load. An experimental study in the dog. IV.
Journal of Clinical Periodontology 29, 144–151.
Gualini, F. & Berglundh, T. (2003). Immunohistochemical characteristics
of infl ammatory lesions at implants. Journal of
Clinical Periodontology, 30, 14–18.
Hultin, M., Gustafsson, A., Hallström, H., Johansson, L-Å,
Ekfeldt, A. & Klinge, B. (2002). Microbiological fi ndings and
host response in patients with peri-implantitis. Clinical Oral
Implants Research 13, 349–358.
Krajicek, D.D., Dooner, J. & Porter, K. (1984). Observations on
the histologic features of the human edentulous ridge. Part
I: Mucosal epithelium. Journal of Prosthetic Dentistry 52,
526–531.
Lang, N.P., Brägger, U., Walther, D., Beamer, B. & Kornman,
K. (1993). Ligature-induced peri-implant infection in cynomolgus
monkeys. Clinical Oral Implants Research 4, 2–11.
Lang, N.P., Karring, T. & Meredith, N. (2002). Consensus
report. Group E summary. Proceedings from the 4th European
Workshop on Periodontology. Journal of Clinical Periodontology
29 (Suppl), 232–234.
Lekholm, U., Adell, R., Lindhe, J., Brånemark, P.I., Eriksson, B.,
Rockler, B., Lindvall, A.M. & Yoneyama, T. (1986). Marginal
tissue reactions at osseointegrated titanium fi xtures. (II) A
cross-sectional retrospective study. International Journal of
Oral & Maxillofacial Implants 15, 53–61.
Leonhardt, Å., Berglundh, T., Ericsson, I. & Dahlén, G. (1992).
Putative periodontal pathogens on titanium implants and
teeth in experimental gingivitis and periodontitis in beagle
dogs. Clinical Oral Implants Research 3, 112–119.
Liljenberg, B., Gualini, F., Berglundh, T., Tonetti, M. & Lindhe,
J. (1996). Some characteristics of the ridge mucosa beforeand after implant installation. A prospective study in
humans. Journal of Clinical Periodontology 23, 1008–1013.
Liljenberg, B., Gualini, F., Berglundh, T., Tonetti, M. &
Lindhe, J. (1997). Composition of plaque associated lesions
in the gingiva and the periimplant mucosa in partially edentulous
subjects. Journal of Clinical Periodontology 24,
119–123.
Lindhe, J., Berglundh, T., Ericsson, I., Liljenberg, B. & Marinello,
C.P. (1992). Experimental breakdown of periimplant
and periodontal tissues. A study in the beagle dog. Clinical
Oral Implants Research 3, 9–16.
Löe, H., Theilade E. & Jensen S.B. (1965). Experimental gingivitis
in man. Journal of Periodontology 36, 177–187.
Marinello, C.P., Berglundh, T., Ericsson, I., Klinge, B., Glantz,
P.O. & Lindhe, J. (1995). Resolution of ligature-induced
peri-implantitis lesions in the dog. Journal of Clinical Periodontology
22, 475–480.
Mombelli, A. (1999). Prevention and therapy of peri-implant
infections. In: Lang, N.P., Karring, T. & Lindhe, J., eds. Proceedings
of the 3rd European Workshop on Periodontology.
Berlin: Quintessence, pp. 281–303.
Mombelli, A. & Lang, N.P. (1998). The diagnosis and treatment
of periimplantitis. Periodontology 17, 63–76.
Persson, L.G., Ericsson, I., Berglundh, T. & Lindhe, J. (1996).
Guided bone generation in the treatment of periimplantitis,
Clinical Oral Implants Research 7, 366–372.
Piattelli, A., Scarano, A. & Piattelli, M. (1998). Histologic
observations on 230 retrieved dental implants: 8 years’
experience (1989–1996). Journal of Periodontology 69,
178–184.
Pontoriero, R., Tonelli, M.P., Carnevale, G., Mombelli, A.,
Nyman, S. & Lang, N.P. (1994). Experimentally induced
peri-implant mucositis. A clinical study in humans. Clinical
Oral Implants Research 5, 254–259.
Roos-Jansåker, A.M., Lindahl, C., Renvert, H. & Renvert, S.
(2006a). Nine- to fourteen-year follow-up of implant treatment.
Part I: implant loss and associations to various factors.
Journal of Clinical Periodontology 33, 283–289.
Roos-Jansåker, A.M., Lindahl, C., Renvert, H. & Renvert, S.
(2006b). Nine- to fourteen-year follow-up of implant treatment.
Part II: presence of peri-implant lesions. Journal of
Clinical Periodontology 33, 290–295.
Roos-Jansåker, A.M., Renvert, H., Lindahl, C. & Renvert, S.
(2006c) Nine- to fourteen-year follow-up of implant treatment.
Part III: factors associated with peri-implant lesions.
Journal of Clinical Periodontology 33, 296–301.
Sanz, M., Aladez, J., Lazaro, P., Calvo, J.L., Quirynen, M. & van
Steenberghe, D. (1991). Histopathologic characteristics of
peri-implant soft tissues in Brånemark implants with two
distinct clinical and radiological patterns. Clinical Oral
Implants Research 2, 128–134.
Schou, S., Holmstrup, P., Stoltze, K., Hjørting-Hansen, E. &
Kornman, K.S. (1993). Ligature-induced marginal infl ammation
around osseointegrated implants and ankylosed
teeth. Clinical and radiographic observations in Cynomolgus
monkeys. Clinical Oral Implants Research 4, 12–22.
Türk, D. (1965). A histologic comparison of the edentulous
denture and nondenture bearing tissues. Journal of Prosthetic
Dentistry 15, 419–434.
van Steenberge, D., Klinge, B., Lindén, U., Quirynen, M., Herrmann,
I. & Garpland, C. (1993). Periodontal indices around
natural titanium abutments: A longitudinal multicenter
study. Journal of Periodontology 64, 538–541.
Weyant, R.J. (1994). Characteristics associated with the loss and
peri-implant tissue health of endosseous dental implants.
International Journal of Oral and Maxillofacial Implants 9,
95–102.
Weyant, R.J. & Burt, B.A. (1993). An assessment of survival
rates and within-patient clustering of failures for endosseous
Enter your text here
Enter your text here


